MDシミュレーションを用いたタンパク質の機能解析
MDシミュレーションを用いたタンパク質の機能解析
MDシミュレーションを用いて、タンパク質が機能するメカニズムを明らかにする研究を行っています。
鉄錯体輸送体の基質認識と輸送機構の解明
鉄錯体輸送体Yellow Stripe 1(YS1)は、Fe3+を結合したムギネ酸(Fe(III)-DMA)(図1)を細胞内に輸送することで、植物の根における難溶性の鉄イオンの吸収に重要な役割を果たしています。低温電子顕微鏡により、YS1単体および、YS1とFe(III)-DMAとの複合体の立体構造決定されました。YS1はFe(III)-DMAをH+と共輸送すると考えられていることから、本研究ではまず、MDシミュレーションを用いて、電子顕微鏡構造におけるプロトン化状態を決定し、続いて輸送に関わるプロトン化部位を決定しました。YS1はcore domainとscaffold domainからなり、core domainがscaffold domainに対して、elevator-like mechanismで移動することで、Fe(III)-DMAを輸送すると考えられています。そこで、core domainの膜貫通領域に存在する3つの酸性残基(D446, D490, D494)(図2)について、すべてのプロトン化状態の組み合わせについて500 nsのMDシミュレーションを行いました。この結果、D494のみがプロトン化している状態では、結合状態が安定に維持されたことから、Fe(III)-DMAが結合した電子顕微鏡構造はこの状態に対応していると考えられました。3つの酸性残基すべてがプロトン化した状態では、電子顕微鏡構造でcore domainと接触しているscaffold domainのTM6がcore domainから離れることから、これらのプロトン化が、core domainの移動を誘起していることが示唆されました(図3)。本研究は、理化学研究所の山形上級研究員らのグループと共同で行いました。
Yamagata et al., Nat. Commun. 13, 7180 (2022).

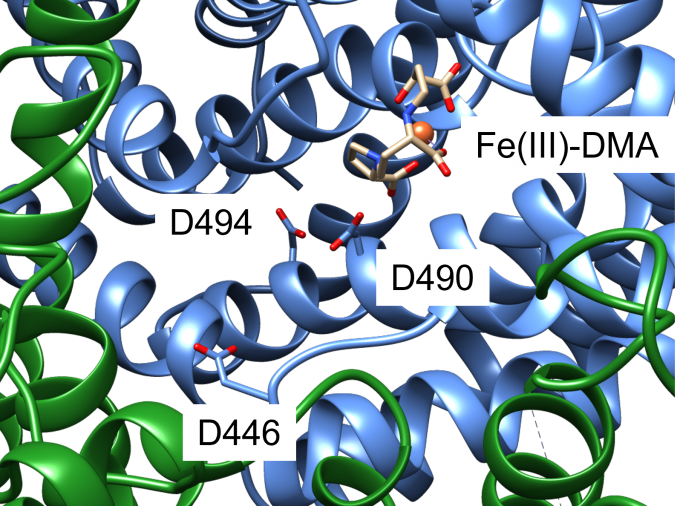
図2: YS1のFe(III)-DMA結合部位付近の拡大図。Core domainを青色、scaffold domainを緑色のリボンモデルで、D446、D490、D494をスティックモデルで表示している。また、Fe(III)-DMAのFe3+イオンを球で、DMAをスティックモデルで表示している。
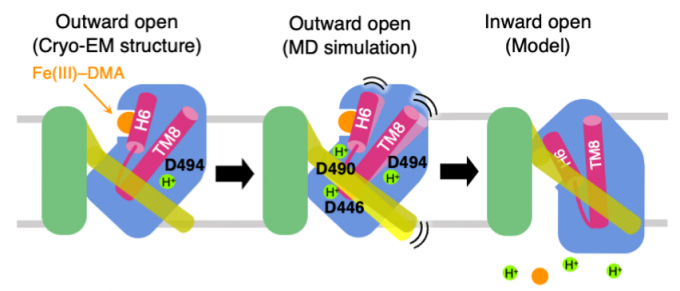
図3: 提唱されたFe(III)-DMAとプロトンの共輸送のメカニズム。(左)低温電子顕微鏡により決定された構造は、細胞外側が開いたoutward open構造をとっており、D494がプロトン化することにより、Fe(III)-DMAを安定に結合する。(中)D446、D490もプロトン化すると、黄色で示したTM6が青色のコアドメインから離れる。(右)細胞内側が開いたinward open構造に遷移し、Fe(III)-DMAとプロトンが細胞内に放出される。
薬剤による心筋イオンチャネル阻害活性の予測
心臓の拍動は、心筋イオンチャネルが作る活動電位の伝播と、これによる筋収縮が協調して起こる現象です。静止状態では、細胞外に対して細胞内の電位が低い分極状態になっていますが、活動電位が伝わり脱分極すると、まずNa+チャネルが開きます。すると、細胞外い多く存在するNa+イオンが細胞内に流入し、細胞外に対して細胞内の電位が高くなります。これにより周辺のNa+チャネルも開き、活動電位が伝播していきます。また、脱分極により、筋小胞体からCa2+イオンが放出され、筋収縮が起こります。一方、K+チャネルは活動電位が伝わると、Na+よりも遅れて開き、今度は、細胞内に多いK+イオンを細胞外に流出させます。これにより、細胞内の電位が下がり、再び細胞外に対して細胞内の電位が低い分極状態に戻ります(図4)。薬剤によりK+チャネルのイオンの通り道(ポア)が塞がれると、再分極が遅れ、心電図のQT間隔が伸びるQT延長を引き起こします。これは致死的な不整脈を引き起こすことがあります。これは、一般に「心毒性」と呼ばれ、新薬は治験で心毒性試験が義務付けられています。これは健康なボランティアが実際に薬を服用することによって行われ、不整脈が起きた場合は開発中止となります。このように、心毒性試験には莫大なコストがかかるだけでなく、倫理的な問題も指摘されています。
こうした問題を軽減するために、計算機による心毒性の予測が試みられています。本研究では、低温電子顕微鏡により決定されたK+チャネル(hERG)とNa+チャネル(NaV1.5)の立体構造を用いて、イオンチャネルへの薬剤の結合親和性を計算する方法を開発しました。ここでは、イオンチャネルのポアの細胞内側に存在する空洞に薬剤をドッキングシミュレーションにより結合させ、MDシミュレーションを用いて精密化した後、MP-CAFEE法を用いて結合自由エネルギー∆Gbindを計算しています。∆Gbindを、50%阻害濃度(IC50)の負の常用対数値(pIC50)に対してプロットしたところ、計算値は、実験値とよく相関することが示されました(図5)。これにより、薬剤候補化合物について、ドッキングシミュレーションと自由エネルギー計算により、心筋イオンチャネルの阻害活性を予測することが可能となりました。
Negami and Terada, BPPB, 20, e200016 (2023).


図5: Comprehensive in vitro Proarrhythmia Assay (CiPA) reference drugsについて計算した∆GbindとpIC50の間の回帰分析。(左)K+チャネル(hERG)に対する計算結果。(右)Na+チャネル(NaV1.5)に対する計算結果。


