そのほかの研究
こちらでは、そのほかの研究成果を紹介します。
機械学習を用いたクライオ電子顕微鏡の高倍率撮影に適した氷膜の判別法の開発
クライオ電子顕微鏡の試料は、多数の穴が規則的に並んだカーボン被膜で覆われた金属製のグリッドに、タンパク質溶液を塗布し、急速に冷却することで作成されます。タンパク質の立体構造を高い分解能で決定するためには、タンパク質が適切な厚さの氷の膜に包埋されていることが重要です(図1)。従来は、熟練した研究者が目視で適切な厚さの氷が張られた膜穴を選択し、撮影を行っていました。本研究では、この負担を軽減し、撮影効率を高めるために、機械学習を用いて適切な厚さの氷が張られた膜穴を判別する手法を開発しました。まず、膜穴の検出にYOLOv3、膜穴の判別にXceptionの、深層学習に基づく2つの手法を組み合わせて判別器を構築しました(図2)。可溶性タンパク質と膜タンパク質の2種類のサンプル(それぞれβ-galactosidase、cytochrome c oxidase)の膜穴の低倍率画像の提供を受け、氷の厚さに応じてgood、badとラベル付けした後、この一部を用いてそれぞれ学習を行い、残りの画像を用いて予測性能のテストを行いました。その結果、accuracy、precision、recallは可溶性タンパク質のサンプルではそれぞれ0.938、0.956、0.952、膜タンパク質のサンプルではそれぞれ0.953、0.951、0.986となり、いずれも高い予測性能を実現しました(図3a)。一方、可溶性タンパク質のサンプルの画像で学習し、膜タンパク質のサンプルの画像に適用したところ、予測性能が低下したことから、サンプル依存性があることが明らかとなりました(図3b)。可溶性タンパク質のサンプルの画像に対する実際の判別の様子を図4に示します。また、高い予測性能を実現するには、2,100個以上の膜穴の低倍率画像を学習する必要があることがわかりました。本研究は、名古屋大学(現・筑波大学)の谷教授らのグループと共同で行いました。
Yokoyama et al., Biophys. Rev. 12, 349–354 (2020).
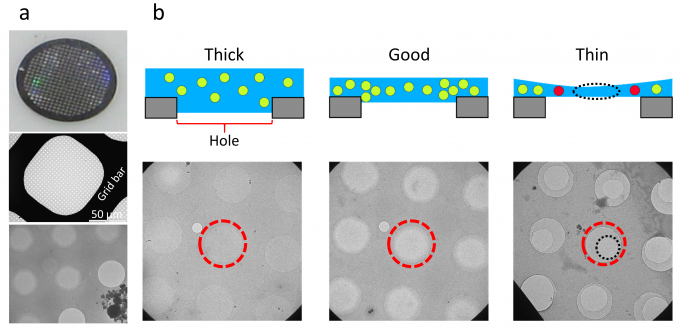
図1: (a)直径3 mmの200メッシュグリッドの全体像(上)、メッシュ1つ分の拡大像(中)、氷が張られた膜穴の拡大像(下)。(b)氷の厚さの違いによる影響の模式図(上)と対応する膜穴(赤破線)の画像(下)。
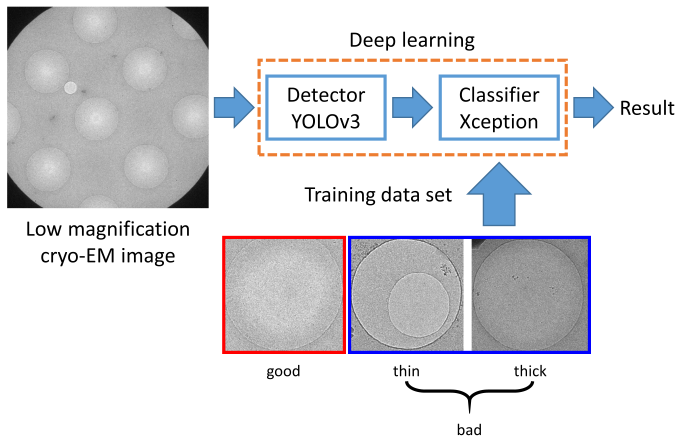
図2: 方法の概要。
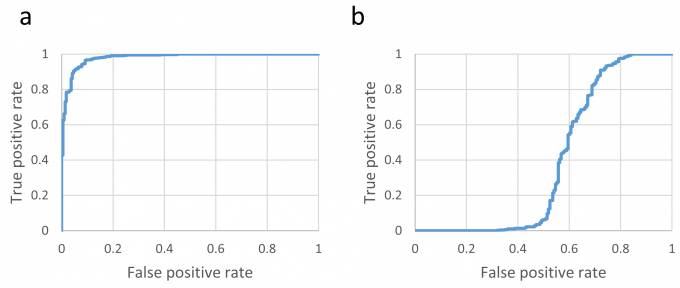
図3: (a)可溶性タンパク質のサンプルのROC曲線。(b)可溶性タンパク質のサンプルの画像で学習し、膜タンパク質のサンプルの画像に適用したROC曲線。

図4: 可溶性タンパク質のサンプルの画像に対する実際の判別の様子。
PyHoleFinderの開発
低温電子顕微鏡のグリッドのメッシュの画像から、膜穴を検出・選別するソフトウェアPyHoleFinderを開発し、公開しています。このプログラムは電子顕微鏡制御ソフトウェアSerialEMのプラグインとして動作させることが可能です。ここでは、近接した膜穴を、ステージを移動することなく一度に撮影できるよう、グループ化する機能を実装し、撮影のさらなる効率化に寄与しています(図5)。
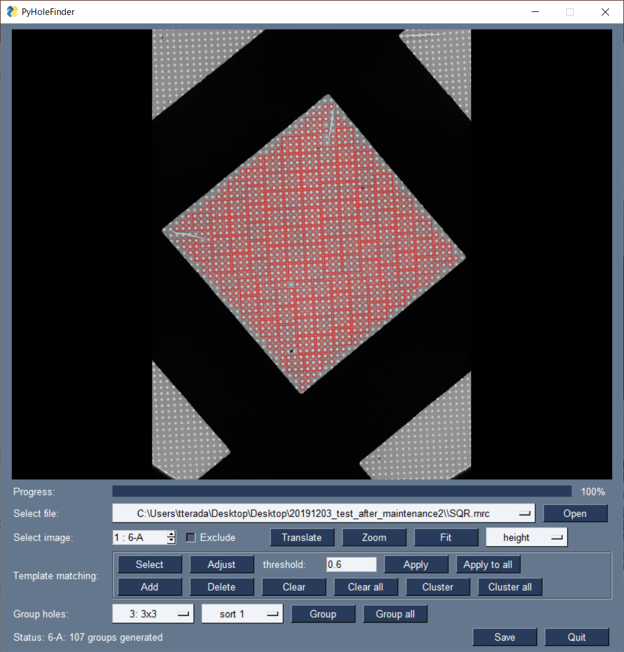
図5: PyHoleFinderを用いて、膜穴を検出し、3×3のグループにグループ化した様子。
